Wytyczne oceny wyrobów medycznych
Celem projektu jest opracowanie wytycznych HTA dla wyrobów medycznych z uwzględnieniem specyfiki różnych grup przeznaczenia i klas bezpieczeństwa wyrobów. Podczas gdy, wytyczne dotyczące oceny HTA technologii lekowych są dobrze ugruntowane na świecie, różnorodność i krótki czas życia wyrobów medycznych powodują, że do tej pory opracowano nieliczne wytyczne adresowane dla tych technologii (w Europie wytyczne dedykowane ocenie wyrobów medycznych opracowane zostały wyłącznie we Francji, Szwecji i Wielkiej Brytanii).
W ramach przygotowań do projektu opracowany został dokument – Przegląd aktualnego stanu wiedzy i rozwiązań, a same prace Agencji opierają się na edycji i adaptacji aktualnych „Wytycznych Oceny Technologii Medycznych (wersja 3.0)”.
Jako pierwszy przygotowany został dokument Wytyczne Oceny Technologii Medycznych. Wyroby medyczne, część I, który, mając zastosowanie w obecnej procedurze refundacyjnej, skupia się na ocenie wyrobów medycznych:
- stosowanych w profilaktyce i terapii;
- produkowanych seryjnie;
- stosowanych indywidualnie przez pacjenta (nie wymagających asysty czy udziału personelu medycznego);
- dostępnych w aptece.
Dokument zapewnia transparentny proces oceny, promujący innowację niosącą postęp kliniczny. Zaś jego wdrożenie ma zapewnić pacjentom dostęp do skutecznych i bezpiecznych wyrobów, tworząc równocześnie przyjazne i przewidywalne środowisko dla producentów wyrobów medycznych. Opracowane wytyczne stanowią odpowiedź na to trudne zadanie przy jednoczesnym uwzględnieniu kluczowych założeń prezentowanych ram oceny:
- wprowadzenia konieczności transparentnego wskazania, w pierwszym rzędzie, wpływu technologii na istotne klinicznie punkty końcowe,
- wydzielenia analizy efektów pozaklinicznych wraz ze wskazaniem dokumentów, które mogą stanowić podstawę do dowodzenia korzyści w tym zakresie,
- wystandaryzowanie wymagań dotyczących analiz, dostosowując je do obszaru wyrobów medycznych (m.in. w obszarze jakości dowodów naukowych),
- podkreślenie znaczenia danych dotyczące stosowania pozyskiwanych z dedykowanych badań w ramach polskiej praktyki klinicznej oraz Real-World Evidence,
- wprowadzenie kaskadowego podejścia do analiz ekonomicznych, gdzie BCA wskazana jest jako właściwa w sytuacji braku wykazania korzyści nowej technologii w analizie klinicznej.
Jest to pierwszy dokument z serii wytycznych dedykowanych wyłącznie wyrobom medycznym. Pozostałe grupy wyrobów medycznych (tj. wyroby diagnostyczne, wyroby implantowalne) będą sukcesywnie obejmowane wytycznymi na dalszych etapach projektu – ze względu na ich zastosowanie i profil bezpieczeństwa, konieczna może być modyfikacja wymagań lub przeprowadzenie dodatkowych analiz. Dlatego liczymy, że niniejsze wytyczne stanowić będą fundamentalny element stymulujący debatę metodyczną, której efekty będą mogły być odzwierciedlone w kolejnych iteracjach projektu.
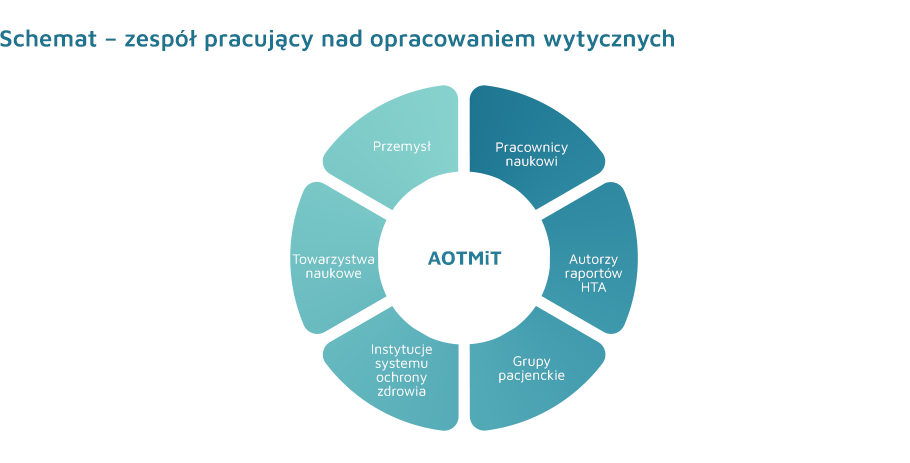
Przedstawiony dokument stanowi efekt współpracy Agencji z szerokim gronem eksperckim, w którego skład wchodzili przedstawiciele przemysłu i twórcy raportów HTA, przedstawiciele grup reprezentujących interesy pacjentów oraz instytucje publiczne. W podjętych pracach Agencja dążyła do konsensusu w stosunku do przyjętych zapisów, a zgłoszone w toku końcowych uzgodnień zdania odrębne do fragmentów dokumentu publikujemy poniżej.
Korespondencja
W związku z procesem finalizacji prac nad dokumentem Wytycznych HTA dla wyrobów medycznych, Agencja publikuje odpowiedzi na przekazane w oficjalniej korespondencji uwagi:
- Stanowisko Izby Gospodarczej „Farmacja Polska” z dnia 7 kwietnia 2021 r.
- Odpowiedź Agencji z dnia 5 maja 2021 r. na stanowisko Izby „Farmacja Polska”
- Stanowisko Ogólnopolskiej Izby Gospodarczej Wyrobów Medycznych POLMED z dnia 14 kwietnia 2021 r.
- Odpowiedź Agencji z dnia 5 maja 2021 r. na stanowisko Izby POLMED
- Stanowisko Organizacji Pracodawców Przemysłu Medycznego TECHNOMED z dnia 14 kwietnia 2021 r.
- Odpowiedź Agencji z dnia 5 maja 2021 r. na stanowisko Organizacji TECHNOMED
Dokumenty do pobrania:
*Szanowni Państwo,
informujemy, iż zamieszczane na stronie Agencji materiały i wyniki dyskusji stanowią efekt pracy koncepcyjnej i procesu analitycznego przeprowadzonego przez zespół Agencji Oceny Technologii Medycznych i Taryfikacji w oparciu o paradygmat EBM, obejmujący: wyszukiwanie, selekcję, syntezę i interpretację dowodów naukowych, lub przeprowadzoną analizę danych. W związku z powyższym, pragniemy przekazać, iż wykorzystywanie materiału analitycznego lub wyników dyskusji, zgodnie z dobrą praktyką, powinno być opatrzone informacją na temat źródła w postaci: [tytuł prezentacji/raportu], AOTMiT, Warszawa, miesiąc 2024 r.]

