EUnetHTA JA3

EUnetHTA JA3
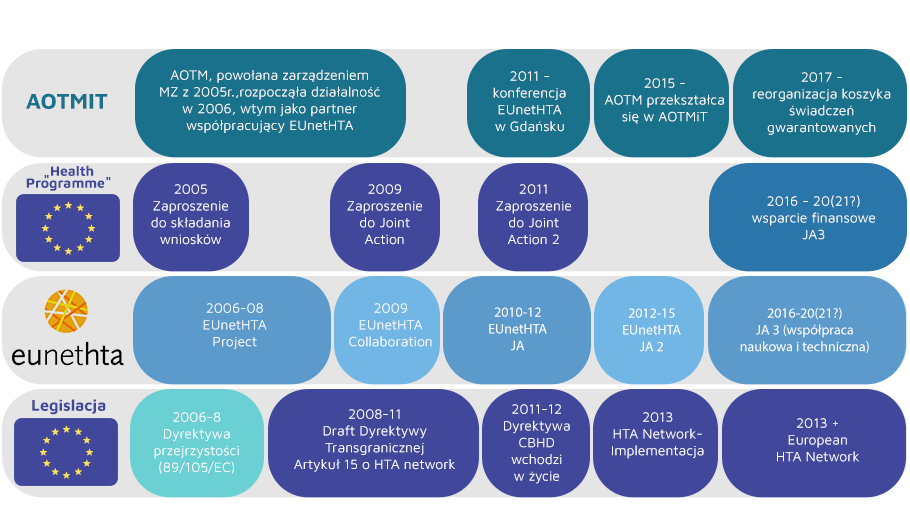
Agencja Oceny Technologii Medycznych i Taryfikacji związana jest z siecią europejskich agencji HTA (ang. European network for Health Technology Assessment, EUnetHTA) od początków jej istnienia i działalności (tj. od 2005 r.).
Zasięg Projektu
Austria
- GOG – Gesundheit Österreich GmbH/Geschäftsbereich
- HVB – Hauptverband der Österreichischen Sozialversicherungsträger (Association of Austrian Social Insurance Institutions)
- AIHTA – Austrian Institute for Health Technology Assessment
- UMIT – University for Health Sciences, Medical Informatics and Technology
Belgia
- IPH – Scientific Institute of Public Health
- KCE – Belgian Health Care Knowledge Centre
- RIZIV-INAMI – Rijksinstituut voor Ziekte- en Invaliditeitsverzekering
Bułgaria
- NCPHA – National Center of Public Health and Analyses
Chorwacja
- MIZ – Ministry of Health of the Republic of Croatia
- CHIF – Croatian Health Insurance Fund
- CIPH – Croatian Institute of Public Health
Cypr
- MoH Cyprus – Ministry of Health of Cyprus
Czechy
Dania
- DEFACTUM (formerly CFK) – DEFACTUM
Estonia
- UTA – Institute of Family Medicine and Public Health
Finlandia
- FIMEA – Finnish Medicines Agency
- FinCCHTA – Finnish Coordinating Center for Health Technology Assessment
- THL – National Institute for Health and Welfare
Francja
- HAS – French National Authority for Health (Haute Autorité de Santé)
Niemcy
- DIMDI – German Institute for Medical Documentation and Information
- GBA – Gemeinsamer Bundesausschuss
- IQWIG – Institute for Quality and Efficiency in Health Care
Grecja
- EKAPTY-NKUA – National and Kapodistrian University of Athens
- EKAPTY SA – National Evalution Center of Quality and Technology in S.A.- EKAPTY
- EOF – National Organization for Medicines
- EOPYY – National Organisation for Healthcare Provision
- IFET – Institute of Pharmaceutical Research and Technology
- OCSC – Onassis Cardiac Surgery Centre
Węgry
Irlandia
- HIQA – Health Information and Quality Authority
- NCPE – National Centre for Pharmacoeconomics, St. James Hospital
Włochy
- Agenas – National Agency for Regional Health Services
- AIFA – Italian Medicines Agency
- CRUF/AOUIVR – Centro Regionale Unico sul Farmaca del Veneta
- DGFDM IT – Sede del Ministro – Ministero della salute
- RER – Regione Emilia-Romagna
- UCSC GEMELLI – University Hospital A. Gemelli
- UVTA/AOP – Unita di Valutazione Technology Assessment
- Veneto/CRUF – Regione Del Veneto – Area Sanita E’ Sociale
Łotwa
- NVD – National Health Service
Litwa
Malta
- DPA/MoH Malta – Directorate for Pharmaceutical Affairs
Holandia
Norwegia
- Hdir – Norwegian Directorate of Health
- NIPHNO (formerly NOKC) – The Norwegian Institute of Public Health
- NOMA – Norwegian Medicines Agency
Polska
- AOTMiT – Agency for Health Technology Assessment and Tariff System
Portugalia
- ACSS IP – Administração Central do Sistema de Saúde, I.P.
- INFARMED – National Authority of Medicines and Health Products
Rumunia
- NIPHB – Institutu National De Sanatate Publica (INSP)
- NSPHMPDB – National School of Public Health, Management and Professional Development
- UBB – Babes-bolayi University, Cluj School of Public Health
Słowacja
- MoH Slovak Republic – Ministry of Health of the Slovak Republic
- UniBA FOF – Comenius University in Bratislava
Słowenia
- JAZMP – Public Agency of the Republic of Slovenia for Medicinal Products and Medical Devices
- MoH Slovenia – Ministry of Health of the Republic of Slovenia
- NIJZ – National instute of Public Health (NIJZ)
Hiszpania
- AEMPS – Agencia Española de Medicamentos y Productos Sanitarios
- AETS-ISCIII – The Instituto De Salud Carlos III
- AETSA – Andalusian HTA Agency
- AQuAS – Agency for Health Quality and Assessment of Catalonia
- AVALIA FNS – Fundacion Profesor Novoa Santos
- AVALIA-T – Galician Agency for HTA
- BIOEF – Basque Foundation for Health Innovation and Research
- DGFPS MSPSI – Directorate General for Pharmacy and Health Care Products
- FPS – Fundación Pública Andaluza Progreso y Salud
- Funcanis – Fundación Canaria de Investigación Sanitaria
- Osteba – Basque Office for Health Technology Assessment- Ministry for Health
- SESCS – Evaluation AND Planning Unit – Directorate of the Canary Islands Health Service
Szwecja
- MPA – Medical Products Agency
- SBU – Swedish Agency for Health Technology Assessment and Assessment of Social Services
- TLV – Dental and Pharmaceutical Benefits Agency
Szwajcaria
- SNHTA – Swiss Network for HTA
Ukraina
- MoH Ukraine – HTA Department of SEC of Ministry of Health of Ukraine
Wielka Brytania
- AWTTC – All Wales Therapeutics and Toxicology Centre
- HIS – Healthcare Improvement Scotland
- NICE – National Institute for Health and Care Excellence
Cel Projektu
Określenie i wdrożenie trwałego i zrównoważonego modelu współpracy w dziedzinie HTA na poziomie europejskim.
Termin Końcowy – maj 2021 r. (przedłużono czas trwania).
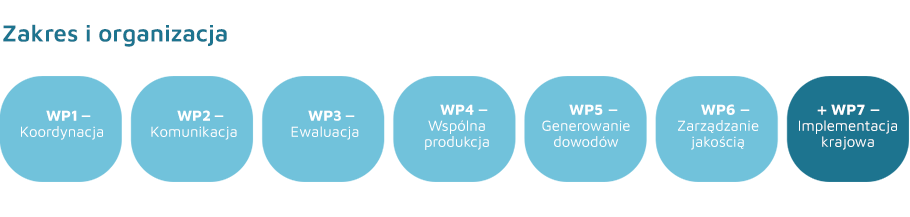
Opis Projektu
- tworzenie wspólnych ocen klinicznych;
- udzielanie konsultacji naukowych producentom leków;
- zbieranie danych porejestracyjnych;
- opracowywanie wytycznych metodologicznych i procedur postępowania.
Agencja ciągle aktywizuje swoją działalność w ramach organizacji, w latach 2019-2020 w ramach przedmiotowego projektu wypracowała:
- jako Współautor: Raport dot. ustekinumabu w wrzodziejącym zapaleniu jelita grubego WZJG;
- jako Recenzent: Raport dot. brolucizumabu w AMD oraz Raport dot. sotagliflozyny w cukrzycy;
- recenzowała również wytyczne metodologiczne: Critical assessment of economic evaluations;
- postępy prac dotyczyły ponadto: pracy w grupach roboczych: Future Model of Cooperation on HTA oraz Common Phrases, współtworzenia SOPów (SOP on Data Extraction) oraz udziału w Information Specialists Pool.
Materiały do pobrania:
Raport dot. brolucizumabu w AMD (Brolucizumab for the treatment of adults with neovascular (wet) age-related macular degeneration (AMD))
Raport dot. sotagliflozyny w cukrzycy (Sotagliflozin for adult patients with Type 1 Diabetes Mellitus who have inadequate blood glucose control using insulin or insulin analogues)
Korzyści ze współpracy:
- możliwość wspólnej pracy i wymiany doświadczeń z prawie wszystkimi europejskimi agencjami HTA;
- bieżące śledzenie trendów rozwoju HTA;
- pozyskiwanie dostępu do danych udzielanych EUnetHTA przez współpracujące podmioty odpowiedzialne;
- networking.

*Szanowni Państwo,
informujemy, iż zamieszczane na stronie Agencji materiały i wyniki dyskusji stanowią efekt pracy koncepcyjnej i procesu analitycznego przeprowadzonego przez zespół Agencji Oceny Technologii Medycznych i Taryfikacji w oparciu o paradygmat EBM, obejmujący: wyszukiwanie, selekcję, syntezę i interpretację dowodów naukowych, lub przeprowadzoną analizę danych. W związku z powyższym, pragniemy przekazać, iż wykorzystywanie materiału analitycznego lub wyników dyskusji, zgodnie z dobrą praktyką, powinno być opatrzone informacją na temat źródła w postaci: [tytuł prezentacji/raportu], AOTMiT, Warszawa, miesiąc 2024 r.]

