Szczepionki
Szczepionka to preparat biologiczny, który w założeniu imituje naturalną infekcję i prowadzi do rozwoju odporności analogicznej do tej, którą uzyskuje organizm w czasie pierwszego kontaktu z prawdziwym drobnoustrojem (bakterią lub wirusem).
Szczepionka składa się z jednego lub kilku antygenów, które uzyskiwane są z żywych lub zabitych drobnoustrojów, ich oczyszczonych fragmentów lub produktów metabolizmu bakterii, jak również w wyniku inżynierii genetycznej. Ponadto szczepionka może zawierać substancje stabilizujące i środki konserwujące, które chronią przed drobnoustrojami, substancje wzmacniające i przyspieszające pojawienie się odporności, a także śladowe ilości substancji pochodzących z procesu produkcji.
Szczepionki żywe wywołują silną odporność już po pojedynczej dawce. Natomiast szczepionki inaktywowane (zabite) wymagają podania kilku dawek. Wprowadzony do organizmu antygen ze szczepionki pobudza komórki układu odpornościowego do produkcji swoistych przeciwciał. Powstają także komórki pamięci immunologicznej, które zapewniają długotrwały efekt ochronny szczepienia. Jeżeli dojdzie do kontaktu z drobnoustrojem chorobotwórczym komórki pamięci immunologicznej prowadzą do wytworzenia swoistych przeciwciał, które uniemożliwiają rozwój choroby.
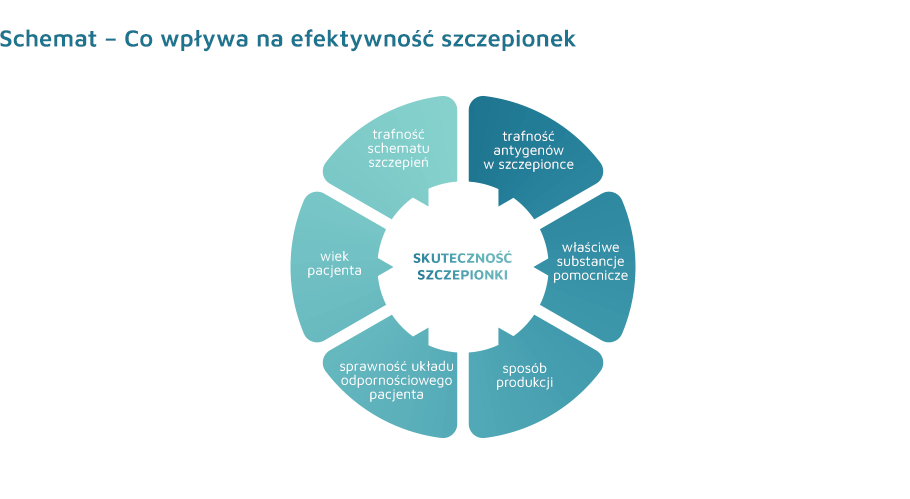
Skuteczność szczepionki zależy od zastosowania odpowiednich antygenów szczepionkowych oraz właściwych substancji pomocniczych, głównie adiuwantów, sposobu produkcji, sprawności układu odpornościowego szczepionej osoby oraz jej wieku, a także odpowiednio dobranego schematu szczepienia.
Zgodnie z art. 31 ca ust. z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych (Dz. U. z 2024 r., poz. 146), Minister Zdrowia może zlecić Prezesowi Agencji, przygotowanie rekomendacji dotyczącej zasadności stosowania leków w ramach Programu Szczepień Ochronnych (PSO), o którym mowa w przepisach o zapobieganiu oraz zwalczaniu zakażeń i chorób zakaźnych u ludzi.
Po otrzymaniu zlecenia, Prezes Agencji wzywa podmiot odpowiedzialny w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne do przekazania:
- analizy klinicznej;
- analizy ekonomicznej;
- analizy wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych;
– o których mowa w art. 25 pkt 14 lit. c tiret pierwsze do trzeciego ustawy o refundacji w terminie 3 miesięcy od dnia otrzymania wezwania.
Do przygotowania rekomendacji stosuje się przepisy art. 31c ust. 3-9 ustawy. Rekomendację wydaje się, w terminie 2 miesięcy od dnia otrzymania analiz albo od upływu terminu na ich przekazanie. W przypadku nieprzekazania analiz, Prezes Agencji wydaje rekomendację na podstawie dostępnych danych.
W przypadku oceny szczepień ochronnych, Agencja przygotowuje materiały analityczne, zgodnie z wytycznymi HTA, z uwzględnieniem oceny efektywności klinicznej, oceny efektywności kosztowej, analizy wpływu na budżet, przeglądu wytycznych praktyki klinicznej i rekomendacji refundacyjnych oraz opinii ekspertów – dotyczących zasadności stosowania ocenianej technologii medycznej w powszechnym szczepieniu realizowanym w ramach Programu Szczepień Ochronnych (PSO).
*Szanowni Państwo,
informujemy, iż zamieszczane na stronie Agencji materiały i wyniki dyskusji stanowią efekt pracy koncepcyjnej i procesu analitycznego przeprowadzonego przez zespół Agencji Oceny Technologii Medycznych i Taryfikacji w oparciu o paradygmat EBM, obejmujący: wyszukiwanie, selekcję, syntezę i interpretację dowodów naukowych, lub przeprowadzoną analizę danych. W związku z powyższym, pragniemy przekazać, iż wykorzystywanie materiału analitycznego lub wyników dyskusji, zgodnie z dobrą praktyką, powinno być opatrzone informacją na temat źródła w postaci: [tytuł prezentacji/raportu], AOTMiT, Warszawa, miesiąc 2024 r.]

