Off – Label
Leki w Polsce mogą podlegać refundacji również we wskazaniach innych niż zarejestrowane i wylistowane w Charakterystyce Produktu Leczniczego. Proces ich obejmowania refundacją odbywa się przy udziale Agencji Oceny Technologii Medycznych i Taryfikacji.
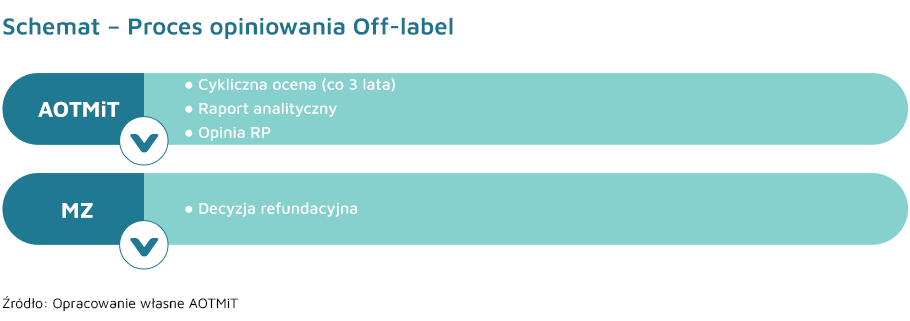
Minister Zdrowia, po zasięgnięciu opinii Rady Przejrzystości oraz konsultanta krajowego z odpowiedniej dziedziny medycyny, może wydać z urzędu decyzję administracyjną o objęciu refundacją leku przy danych klinicznych, w zakresie wskazań do stosowania lub dawkowania, lub sposobu podawania odmiennych niż określone w Charakterystyce Produktu Leczniczego (tzw. off-label) w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne.
Odbywa się to w oparciu o kryteria omawiane w materiałach przygotowywanych przez Agencję, tj.:
- skuteczność kliniczna i praktyczna;
- bezpieczeństwo stosowania;
- relacja korzyści zdrowotnych do ryzyka stosowania;
- wpływ na wydatki podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych i świadczeniobiorców;
- istnienie alternatywnej technologii medycznej oraz jej efektywność kliniczna i bezpieczeństwo stosowania;
- mapy potrzeb zdrowotnych;
- wysokość progu kosztu uzyskania dodatkowego roku życia skorygowanego o jakość.
Opinię w temacie objęcia refundacją technologii we wskazaniu pozarejestracyjnym Rada Przejrzystości wydaje w terminie nie później niż 30 dni, od otrzymania zlecenia od Ministra Zdrowia, biorąc pod uwagę istotność stanu klinicznego, w którym ma być stosowany lek, skuteczność kliniczną i praktyczną, bezpieczeństwo stosowania, relację korzyści zdrowotnych do ryzyka stosowania, wpływ na wydatki podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych i świadczeniobiorców oraz istnienie alternatywnej technologii medycznej. Przedmiotowe opinie Rady Przejrzystości obowiązują przez okres 3 lat. W terminie 30 dni przed upływem terminu obowiązywania poprzedniej opinii, Rada Przejrzystości oraz konsultant krajowy w odpowiedniej dziedzinie medycyny wydają kolejną opinię, w odniesieniu do danej substancji czynnej w określonym wskazaniu, chyba że:
- Minister Zdrowia przekaże Prezesowi Agencji lub konsultantowi krajowemu w odpowiedniej dziedzinie medycyny informację, o zamiarze odstąpienia od refundacji w tym wskazaniu lub
- dane wskazanie zostanie ujęte w Charakterystyce Produktu Leczniczego.
Prezes Agencji publikuje w Biuletynie Informacji Publicznej Agencji rzeczoną opinię Rady Przejrzystości, wraz z określeniem terminu jej ważności, łącznie z materiałami, na podstawie których została wydana.
*Szanowni Państwo,
informujemy, iż zamieszczane na stronie Agencji materiały i wyniki dyskusji stanowią efekt pracy koncepcyjnej i procesu analitycznego przeprowadzonego przez zespół Agencji Oceny Technologii Medycznych i Taryfikacji w oparciu o paradygmat EBM, obejmujący: wyszukiwanie, selekcję, syntezę i interpretację dowodów naukowych, lub przeprowadzoną analizę danych. W związku z powyższym, pragniemy przekazać, iż wykorzystywanie materiału analitycznego lub wyników dyskusji, zgodnie z dobrą praktyką, powinno być opatrzone informacją na temat źródła w postaci: [tytuł prezentacji/raportu], AOTMiT, Warszawa, miesiąc 2024 r.]

